Vaincre la maladie du sommeil
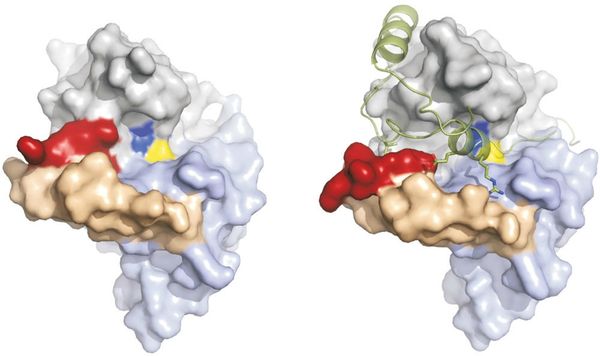
Structure 3D de la cathepsine B. DANS la conformation «fermée», juin boucle d'occlusion (rigide segment: beige; segment flexible: rouge). Bloque l'Accès au site support Le propeptide de liaison de la party Se déplace souple de la boucle Telle Sorte de Québec les Partenaires de la cathepsine Réactifs B-peut atteindre le site de du Substrat.
Science ExpressVaincre la maladie du sommeil en décryptant la structure de la protéine cathepsine B, vitale pour la survie du parasite Trypanosoma brucei transmis par la mouche tsé-tsé, c’est la performance de des scientifiques de l'Institut Max Planck, retenue comme l’une des 10 percées scientifiques 2012, par la revue Science. Alors que la maladie tue 30.000 personnes chaque année dans le monde, que les médicaments disponibles sont d'une efficacité limitée et que la résistance est en augmentation. Une avancée, donc, qui va permettre le développement d’un médicament prometteur ciblant la protéine cathepsine B.
Grâce à une technique par laser à rayons X, cette équipe internationale de chercheurs, dont des scientifiques de l'Institut Max Planck précise, en 3 D, la structure de la protéine (Voir visuel ci-contre), une cible prometteuse car son activité enzymatique est vitale pour la survie du parasite. Mais voilà, les inhibiteurs de la cathepsine B doivent être hautement spécifiques contre la variante « trypanosome » de la mouche Tsé Tsé car elle ressemble à la forme humaine. Pour obtenir cette structure biologique spécifique, les chercheurs l’ont cristallisé in vivo dans les cellules qui produisent la protéine. Cette approche fournit des protéines, mais les cristaux obtenus sont minuscules…
Ici intervient le laser à Electrons Libres (LEL) –de Stanford-, à puissance très élevée qui a permis de préciser la structure de la protéine dont les minuscules cristaux ont été exposés aux rayons X. Les auteurs expliquent l’importance de cet outil pour étudier les protéines qui, la plupart du temps ne forment pas de cristaux de taille suffisante pour pouvoir être analysées par rayons X conventionnels. L’étude de ces minuscules cristaux est désormais possible grâce à l'intensité extrême du LEL dont les impulsions ultracourtes « vont » plus vite que les dégâts induits par les radiations.
L'analyse a donc permis de reconstituer la structure de cristaux de cathepsine B in vivo et apporte de nouvelles informations biologiques, montrant, en détail, comment les structures des protéines cathepsine B, « trypanosome » et humaines diffèrent et comment un inhibiteur naturel les lie. Ces résultats constituent donc un grand pas vers la conception de nouveaux médicaments contre la maladie du sommeil.
---------------------

/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F1%2F3%2F138481.jpg)


/https%3A%2F%2Fassets.over-blog.com%2Ft%2Fcedistic%2Fcamera.png)
/http%3A%2F%2Ffibromyalgies.fr%2Fwp-content%2Fuploads%2F2014%2F03%2F168451_1705517514459_967890_n.jpg)